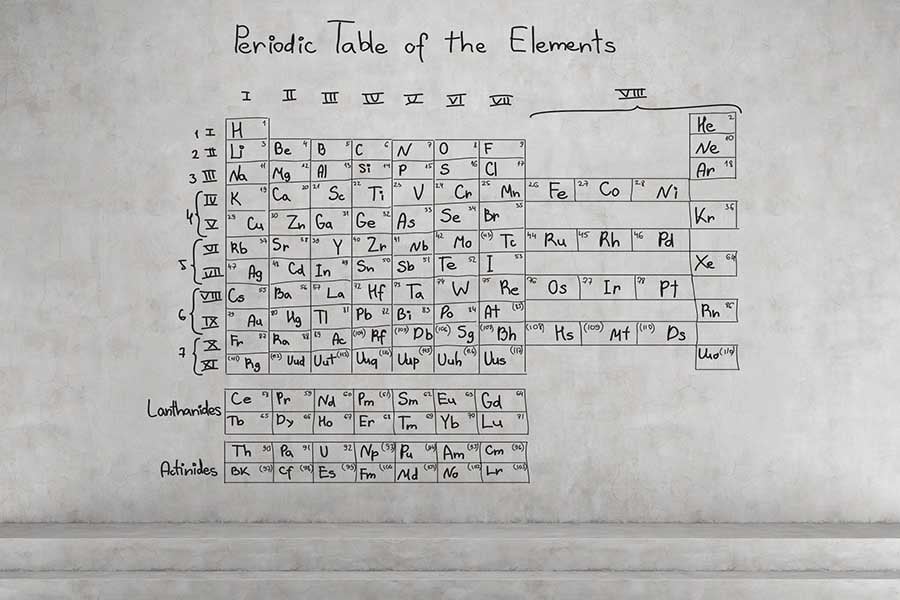
Периодичната система и периодичният закон
В естествения свят съществува скрита хармония, управлявана от периодичния закон – фундаментален принцип, който лежи в основата на всичко в природата и изяснява същността на елементите, изграждащи материята, осветлявайки една забележителна закономерност в поведението им.
Този закон накратко заявява, че физичните и химичните свойства на елементите са периодични функции на броя на протоните в техните атомни ядра. Тази циклична закономерност е отразена в периодичната система, позната ни като Менделеевата таблица.
Химията в древността
В древността химията не е била това, което познаваме днес, но са съществували начини за разпознаването на различните вещества, като са били известни и използвани някои от основните метали, сред които злато, живак, калай, сребро, олово, желязо и мед.
Учението за атомизма, според което материята се състои от по-малки частици – атоми, още преди изобретяването на микроскопа, се приписва на древногръцките философи Левкип и Демокрит. A Емпедокъл и Аристотел развиват теорията за четирите елемента, които са произлезли от един първичен, наричан етер или ефир.
Средновековието и Ренесансът пък са времена на разцвета на предшественичката на химията и фармацията – алхимията. В резултат на стремежа на арабските и европейските алхимици към превръщането на неблагородни метали в злато и откриването на еликсира на безсмъртието, са открити и много химични елементи и метали.
Филипус Ауреол Теофраст Бомбастус фон Хогенхайм или известен като Парацелз поставя алхимията в услуга на медицината, като развива ятрохимията (от старогръцки “ἰατρός”, “медицина”). Той въвежда някои химични елементи в медицинската практика като антимон, живак, арсен, олово и други.
През 17-ти век започват да се търсят начини за класификация на химичните вещества. Робърт Бойл, наричан “бащата на съвременната химия”, предлага разделянето на веществата на киселини, основи и соли, като по този начин поставя основите за бъдещата им класификация. A през 18-ти и 19-ти век се правят и първите опити за систематизация на познатите дотогава химичните елементи.
Антоан Лавоазие, френски химик, предлага класификация въз основа на тяхната химическа реактивност, но най-значителната стъпка в развитието на периодичната система прави Дмитрий Иванович Менделеев през 1869 година.
Периодичната система – история и откриватели

Дмитрий Менделеев, руски енциклопедист, химик, физик, икономист, технолог, метеоролог и педагог, е ученият, чийто труд ни осигури едно ефективно и точно подреждане на елементите, което формира крайъгълния камък на съвременната химия.
Въпреки това разработването на периодичната система не е дело само на един човек. Това е съвместно усилие, изтъкано от приноса на много светила в областта на химията през вековете.
В началото на 19 век английският химик Джон Далтън въвежда съвременната концепция за атомната теория, според която цялата материя е съставена от малки частици, наречени атоми.
По това време множество учени започват да правят и сериозни опити за класификация на химичните елементи, търсейки скритата закономерност, която да обедини техните свойства.
Уилям Одлинг, Джон Нюландс и Густавус Хинрих подреждат елементите, но не успяват да предложат система, която да бъде широко приета от научната общност. Въпреки това техните предложения са важни за развитието на химията.
През 1869 година Менделеев публикува своята периодична таблица, предхождаща тази, която използваме днес. През същата година, но няколко месеца по-късно, Лотар Мейер съставя своята таблица на химичните елементи, която е много подобна на тази на Менделеев.
В началото на 20-ти век английският физик Хенри Моузли въвежда концепцията за атомно число, което се определя от броя на протоните в ядрото на атома като основа за организиране на елементите, което допринася за по-точното представяне на свойствата на елементите в периодичната система.
Периодичната таблица днес съдържа 118 елемента, като съществува 119-ти хипотетичен елемент – унунений.
Заслугата на Дмитрий Менделеев е, че не само организира известните дотогава елементи, но и също така оставя запазени места за все още неоткрити, като предсказа техните свойства.
Днес периодичната таблица продължава да се развива, тъй като учените откриват нови елементи, а Международният съюз за чиста и приложна химия (IUPAC) наблюдава стандартизацията и актуализацията й, като гарантира, че тя остава ценен инструмент за учените по целия свят.
Основни понятия в химията
Преди да пристъпим към същността на периодичния закон, ще изложим някои от основните понятия в химията.
| Понятие | Дефиниция |
|---|---|
| Атомен номер (Z) | Представлява броя на протоните в ядрото на атома и определя мястото на елемента в периодичната таблица, предоставяйки по-точна систематизация на химичните елементи. |
| Атомна маса | Това е средното аритметично от масата на всички изотопи на даден химичен елемент. Атомната маса на елемента се използва за изчисляване на молекулната маса на химичните съединения. |
| Изотоп | Вариант на даден елемент, който имат еднакъв брой протони, но различен брой неутрони в ядрото си. Изотопите на един и същи елемент имат сходни химични свойства, но различни масови числа. |
| Масово число (A) | То представя сумата от броя на протоните и неутроните в ядрото на атома на даден химичен елемент. |
| Електронна конфигурация | Това е разпределението на електрони около атомното ядро в определени обвивки, обозначени с главни квантови числа (n = 1, 2, 3 и т.н.), като всяка има поднива – s, p, d и f орбитали, които могат да поемат различен брой електрони. |
| Атомен радиус | Разстоянието от центъра на атома до най-външната граница на електронния облак. |
| Валентност | Способността на атомите на един елемент да образува химични връзки с определен брой атоми от други елементи. |
| Електроотрицателност | Мярка за способността на атома да привлича електрони към себе си в химичните връзки с други атоми. Колкото е по-голяма електроотрицателността, толкова по-силно атомът привлича електроните към себе си. |
| Йонизационна енергия | Енергията, необходима за отделяне на един електрон от атома в основното му състояние. |
| Електронно сродство | Енергията, която характеризира приемането на електрон от атома в основно състояние. |
Периодичната таблица – същност и разположение на елементите

Периодичният закон отразява цикличността в природата. Менделеев забелязва, че когато елементите се подреждат в нарастващ ред на атомните си маси, характеристиките им, като например радиус на атома, йонизационна енергия, електронно сродство и химични свойства, се повтарят периодично.
Той съставя своята таблица като подрежда елементите в редове (периоди) и колони (групи) въз основа на техните атомни маси, но среща някои несъответствия.
Впоследствие се разбира, че най-важната характеристика, отразяваща цикличността на елементите, е броят протони в атомите им.
Така, на базата на броя протони, всеки елемент заема своето място в периодичната система, като първият е водородът, който има един протон в ядрото си.
Периодите в таблицата съответстват на броя на електронните обвивки около атомните ядра на елементите и са обозначени с арабски числа. А групите отразяват броя на валентните електрони, които елементите имат във външната си електронна обвивка и са номерирани с римски числа.
Всяка нова електронна обвивка на атомите на елементите при преминаване към следващия период променя характеристиките им, като радиус на атома, енергия за йонизация, електронно сродство и химични свойства.
Всяка група има общи свойства поради подобната им електронна конфигурация. Например всички елементи от една и съща група имат същия брой електрони във външната си обвивка, което определя техните химични свойства.
По периоди характеристиките на елементите се променят по следния начин:
- Атомен радиус. Намалява от ляво надясно, тъй като с нарастване на броя протони се увеличава броят електрони, което води до по-силно привличане на електронните облаци.
- Електроотрицателност. Нараства от ляво на дясно, тъй като атомите стават по-малки и по-силно привличат електроните към себе си.
- Йонизационна енергия. Нараства от ляво надясно, тъй като атомите стават по-малки и електроните стават по-трудно отделяеми от тях.
- Електронно сродство. Нараства от ляво надясно, тъй като атомите стават по-малки и имат по-голяма склонност да приемат допълнителни електрони.
По групи характеристиките на елементите се променят по следния начин:
- Атомен радиус. Нараства от горе на надолу, тъй като се добавят нови електронни обвивки, което води до по-голям обем на електронните облаци.
- Електроотрицателност. Намалява от горе надолу, тъй като атомите стават по-големи и по-далеч от ядрото, което намалява тяхната способност да привличат електрони към себе си.
- Йонизационна енергия. Намалява от горе надолу, тъй като е по-лесно да се отделят електрони от атомите с по-големи размери.
- Електронно сродство. Намалява от горе надолу, тъй като атомите стават по-големи и имат по-малка склонност да приемат допълнителни електрони.
Всеки период обикновено започва с алкални метали, които са характерни със своите метални свойства, като висока реактивност и ниски температури на топене и кипене.
След алкалните метали свойствата на елементите постепенно се променят, преминавайки през алкалоземни метали към преходните метали, като последната група се състои от благородни или инертни газове.
Инертните газове се характеризират с висока устойчивост на външните си електронни обвивки и са по-слабо реактивни, поради което са наречени “благородни”, подобно на благородните метали.
Първият елемент нютоний

Всички познаваме добре Менделеевата таблица още от училище, но в оригиналния си вид тя е имала един малък, но много важен детайл. Менделеев поставя един елемент в нулева група, който кръщава нютоний, в чест на Исак Нютон, а преди водорода – короний (от слънчевата корона).
Този елемент всъщност е споменаван още от античността, като древните гърци го описвали като по-фин слой на въздуха, но Аристотел го класифицира като отделен сам по себе си елемент от четирите основни (огън, вода, земя, въздух).
Това е петият елемент – ефирът или етерът. В “Основи на химията” през 1871 за него Менделеев пише: “Най-лек от всички е етерът с една милионна част от теглото на водорода” като според него той е връзката между материята и енергията.
Според Нютон етерът е нещо „духовно, проникващо, оцветяващо и неподкупно, което се появява отново от четирите елемента, когато те са свързани заедно“. Той е ключът към разбирането на взаимодействията между материята и енергията, като създава основата за възникването на различните форми на материята.
Никола Тесла, друг гений на своята епоха, също е бил привлечен от идеята за етера. Той създава устройства, които използват енергията на етера, като се стреми към разбиране и използване на този мистичен елемент за напредък в науката и технологията.
Въпреки че концепцията за етера е била отхвърлена от научната общност, идеите и теориите, свързани с нея, имат важно значение за развитието на науката и технологиите и продължава да буди интерес и до днес.
Често задавани въпроси
Какво представлява периодичният закон?
Периодичният закон описва регулярните и предвидими повторения в химичните свойства на елементите спрямо техните атомни номера.
Какво представлява периодичната таблица?
Периодичната таблица е организация на елементите според техните атомни номера и химични свойства.
Кога е публикувана за пръв път?
Периодичната таблица е публикувана за пръв път от Димитрий Менделеев през 1869 година.
Източници
- Rocke, A.J. Mendeleev’s periodic law, Britannica
- Edwards, P. et al. "The periodic law of the chemical elements: ‘The new system of atomic weights Published online 2020 Aug 17which renders evident the anal NIHogies which exist between bodies", NIH, Published online on August 17, 2020
- NIH. Periodic Table of Elements
- International Union of Pure and Applied Chemistry. IUPAC PERIODIC TABLE OF ELEMENTS
Блог
Рецепти
Популярни продукти
Свързани публикации
Може да не сте чували за микроелемента молибден, но той е от съществено значение за човешкото здраве. Въпреки
Фосфорът е химичен елемент, открит през 1669 г. от немския алхимик Хениг Бранд. В човешкото тяло този минерал
Ролята на минерала мед е сред основните за много ензими. Участва в поддържането на костите и хрущялите, но